鉻是造成水體重度污染的元素之一����,水體除鉻主要有還原沉淀法、離子交換法、光催化還原法等�。
(1)還原沉淀法:向水體中加入FeSO4�、CaSO3等將高毒性Cr(Ⅵ)還原為低毒性Cr(Ⅲ),再調(diào)節(jié)pH使Cr(Ⅲ) 生成Cr(OH)3沉淀除去����。
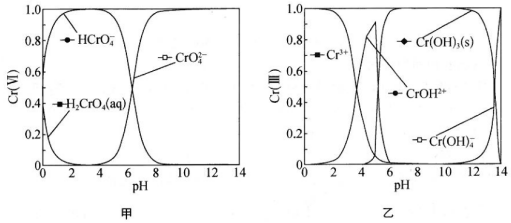
①Cr(Ⅵ)在水溶液中的存在形態(tài)分布如圖甲所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4����,發(fā)生的主要反應(yīng)的離子方程式為
HCrO4-+3Fe2++7H+=3Fe3++Cr3++4H2O
HCrO4-+3Fe2++7H+=3Fe3++Cr3++4H2O
�����。
②Cr(Ⅲ)在水溶液中的存在形態(tài)分布如圖乙所示�����。當(dāng)pH>12時(shí)���,鉻去除率下降的原因可用離子方程式表示為 Cr3++4OH-=Cr(OH)4-
Cr3++4OH-=Cr(OH)4-
。
(2)離子交換法:用強(qiáng)堿性離子交換樹脂(ROH)與含鉻離子(CrO42-�����、HCrO4-等)發(fā)生離子交換�。如與CrO42-的交換可表示為2ROH(s)+CrO42-(aq)?R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率與pH關(guān)系如圖丙所示��,當(dāng)pH>4時(shí)����,Cr(Ⅵ)去除率下降的原因是 pH升高導(dǎo)致離子交換平衡左移,pH>4后HCrO4-轉(zhuǎn)化為CrO42-,交換CrO42-所需的OH-的量是交換HCrO4-所需OH-的量的兩倍
pH升高導(dǎo)致離子交換平衡左移��,pH>4后HCrO4-轉(zhuǎn)化為CrO42-���,交換CrO42-所需的OH-的量是交換HCrO4-所需OH-的量的兩倍
��。
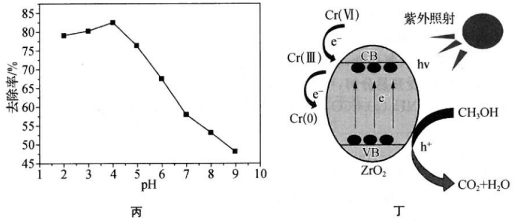
(3)光催化還原法:可能的反應(yīng)機(jī)理如圖丁所示��,ZrO2納米管為催化劑���,在紫外光照射下��,VB端光生空穴(h+)被犧牲劑甲醇(CH3OH)消耗��。在紫外光照射下���,甲醇還原Cr(Ⅵ) 的過程可描述為:甲醇在VB端失去電子e-���,并被轉(zhuǎn)移到CB端,Cr(Ⅵ)在CB端得到電子還原為Cr(Ⅲ)����,Cr(Ⅲ)可以進(jìn)一步得到電子還原為Cr(0)
甲醇在VB端失去電子e-,并被轉(zhuǎn)移到CB端,Cr(Ⅵ)在CB端得到電子還原為Cr(Ⅲ)��,Cr(Ⅲ)可以進(jìn)一步得到電子還原為Cr(0)
�����。
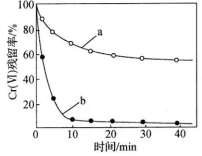
(4)金屬也可用于還原廢水中的Cr(Ⅵ)�。其他條件相同時(shí),用相同物質(zhì)的量的Zn粉����、Zn-Cu粉分別處理pH=2.5的含Cr(Ⅵ)廢水,廢水中Cr(Ⅵ) 殘留率隨時(shí)間的變化如圖所示�。圖中b對(duì)應(yīng)的實(shí)驗(yàn)方法處理含Cr(Ⅵ)廢水的效果更好,其原因是 Zn-Cu粉在溶液中形成原電池����,加快反應(yīng)速率
Zn-Cu粉在溶液中形成原電池,加快反應(yīng)速率
��。