為驗(yàn)證氧化性Cl2>Fe3+>SO2���,某小組用如圖所示裝置進(jìn)行實(shí)驗(yàn)(夾持儀器和A中加熱裝置已略)����。
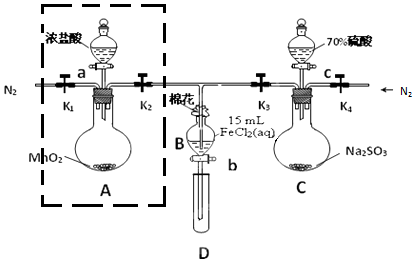
實(shí)驗(yàn)過程:
Ⅰ.查好裝置的氣密性后����,在各儀器中添加相應(yīng)試劑
Ⅱ.打開彈簧夾K1~K4,通入一段時(shí)間N2��,再將T型導(dǎo)管插入B中��,繼續(xù)通入N2���,然后關(guān)閉K1�����、K3�、K4
Ⅲ.打開活塞a,滴加一定量的濃鹽酸�����,給A加熱
Ⅳ.當(dāng)B中溶液變黃時(shí)��,停止加熱,關(guān)閉K2
Ⅴ.打開活塞b,使約2mL的溶液流入D試管中�����,檢驗(yàn)其中的離子��。
Ⅵ.打開K3和活塞c,加入70%的硫酸����,一段時(shí)間后關(guān)閉K3
Ⅶ.更換試管D,重復(fù)過程V�����,檢驗(yàn)B溶液中的離子
(1)檢驗(yàn)虛線框內(nèi)裝置氣密性的操作是
關(guān)閉K1�、K2��,打開分液漏斗的蓋子和活塞��,向其中加水�,一段時(shí)間后分液漏斗尖嘴處不再滴液即證明氣密性良好
關(guān)閉K1、K2��,打開分液漏斗的蓋子和活塞��,向其中加水,一段時(shí)間后分液漏斗尖嘴處不再滴液即證明氣密性良好
�����。
(2)B棉花中浸潤(rùn)的溶液為NaOH溶液
NaOH溶液
�����。實(shí)驗(yàn)Ⅱ通入N2的作用是排除裝置內(nèi)的空氣��,防止FeCl2溶液被O2氧化
排除裝置內(nèi)的空氣�����,防止FeCl2溶液被O2氧化
�����。
(3)C中發(fā)生反應(yīng)的化學(xué)方程式Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
�。
(4)用70%的硫酸制取SO2,反應(yīng)速率比用98%的硫酸快�����,原因是70%的硫酸中的H+的濃度比98%的硫酸中的H+的濃度大
70%的硫酸中的H+的濃度比98%的硫酸中的H+的濃度大
����。
(5)若將制取的SO2通入酸性高錳酸鉀溶液可使溶液褪色�,其離子方程式為2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
�����。
(6)甲�、乙、丙三位同學(xué)分別完成了上述實(shí)驗(yàn)�����,結(jié)論如表所示����。他們的檢測(cè)結(jié)果一定能夠證明氧化性Cl2 >Fe3+>SO2的是甲�、丙
甲、丙
(填“甲”“乙”“丙”)����。



